Лечение хронического гепатита С новыми противовирусными препаратами прямого действия (ПППД) приводит к быстрому регрессу фиброза печени, оцененному транзиентной эластографией и тестами FIB-4 и APRI.
Введение
Новые противовирусные препараты прямого действия при хроническом гепатите С (ХГС), такие как Софосбувир (SOF), Ледипасвир/Софосбувир (LDV/SOF), Паритапревир/Ритонавир/Омбитасвир (PAR/r/OBV) и Дасабувир (DAS), Даклатасвир (DCV) или Симепревир (SMV), вошли в клиническую практику, начиная с декабря 2013 года. Эти новые терапевтические средства имеют минимальные побочные эффекты и достигают показателей устойчивого вирусологического ответа (УВО) у значительно выше 90% в большинстве групп пациентов. Предыдущие схемы лечения на основе пегилированного (ПЭГ) интерферона явно уступают этим новым схемам и были заменены ПППД-терапией в международных рекомендациях для большинства пациентов.
Оценка воспалительной активности и стадии фиброза до лечения ВГС является распространенной практикой и даже требуется во многих странах для получения компенсации за ПППД-терапию.
В качестве альтернативы биопсии печени транзиентная эластография (ТЭ) стала основной неинвазивной оценкой фиброза печени и заменила биопсию в некоторых случаях.
Метод TЭ был введен в 2003 году. Из доступных неинвазивных методов, метод ТЭ — наиболее точный с повышающейся чувствительностью и специфичностью для продвинутых стадий фиброза. TЭ обычно выполняется во многих центрах для оценки фиброза до лечения ВГС и для дальнейшего наблюдения пациентов, которые достигают УВО. Значимость уменьшения результатов ТЭ после ПППД-терапии в отношении дальнейшего ведения и наблюдения пациентов неясна.
Помимо биопсии печени и TЭ, для оценки фиброза печени в недавнее время были разработаны и утверждены множество методов расчета степени фиброза по лабораторным значениям.
Преимущество этих показателей очевидно, поскольку они не требуют ни инвазивной и отнимающей много времени процедуры, ни дорогостоящего оборудования, кроме лабораторного.
Методы Fibrosis-4 (FIB-4) и аспартатаминотрансферазно-тромбоцитный индекс (APRI) были утверждены для хронического гепатита С (ХГС) и показывают приемлемую чувствительность и специфичность, особенно для продвинутого фиброза и цирроза печени.
Предыдущие исследования для интерфероновой терапии показали, что в течение нескольких лет после достижения УВО фиброз печени и даже цирроз могут регрессировать у большого процента пациентов с ВГС. Эта регрессия фиброза была связана с уменьшением риска осложнений, связанных с печенью, таких, как декомпенсация, кровотечение из варикозно расширенных вен и развитие гепатоцеллюлярной карциномы (ГЦК).
Необходимость наблюдения после УВО, особенно в случаях регрессии фиброза, остается предметом для обсуждения. Текущие гайд-лайны рекомендуют пожизненный раз в 6 месяцев ультразвуковой скрининг для всех пациентов с продвинутым фиброзом (F3 по шкале Метавир) и циррозом печени, даже если достигнут УВО, из-за постоянного повышенного риска развития ГЦК.
Недавние исследования подтверждают идею о том, что TЭ может быть полезным инструментом для прогнозирования неблагоприятных событий для ХГС-пациентов после УВО и может помочь в организации наблюдения.
В ходе дальнейшего применения ПППД-лечения ХГС было отмечено поразительно быстрое снижение значений TЭ. Это согласуется с недавним наблюдением Мандорфера и его коллег, что достижение УВО после ПППД-лечения уменьшает портальную гипертензию, вызванную ВГС.
Целью данного исследования было I) оценить количественно снижение TЭ в большой группе пациентов с ВГС после ПППД-лечения, II) выявить факторы, связанных с регрессией TЭ, но других, чем ПППД-лечение или их отсутствие и III) соотнести результаты ТЭ с результатами фиброза, рассчитанными по сывороточным маркерам тестами FIB-4 и APRI.
Врачи отмечают, что безинтерфероновые схемы лечения, применяемые при вирусных гепатитах, могут приводить к прогрессированию фиброза печени. Несмотря на высокую эффективность этих методов в подавлении вирусной нагрузки, некоторые специалисты выражают обеспокоенность по поводу их долгосрочных последствий. Исследования показывают, что у пациентов, получающих такие схемы, наблюдается увеличение степени фиброза, что может негативно сказаться на функции печени и повысить риск развития цирроза. Врачи подчеркивают важность регулярного мониторинга состояния печени у пациентов, проходящих лечение безинтерфероновыми препаратами, и рекомендуют рассматривать возможность комбинированной терапии для минимизации рисков.

Материалы и методы
Структура исследования
Это исследование было создано как мультицентровое наблюдательное исследование. Данные были собраны как ретроспективно, так и в ходе наблюдения. Данные были проанализированы в отношении уменьшения значений TЭ, FIB-4 и APRI для оценки фиброза у пациентов с ХГС, получавших ПППД-терапию.
Безинтерфероновые схемы лечения фиброза вызывают множество обсуждений среди пациентов и специалистов. Многие отмечают, что такие методы лечения значительно упрощают процесс, так как не требуют инъекций и имеют меньше побочных эффектов по сравнению с традиционными интерфероновыми терапиями. Пациенты делятся положительными отзывами о более комфортном течении терапии и улучшении качества жизни. Однако, несмотря на оптимистичные результаты, некоторые врачи выражают осторожность, подчеркивая необходимость индивидуального подхода и тщательного мониторинга состояния здоровья. Важно помнить, что эффективность лечения может варьироваться в зависимости от стадии заболевания и особенностей организма. Поэтому консультация с врачом остается ключевым моментом в выборе подходящей схемы терапии.

Исследование популяции
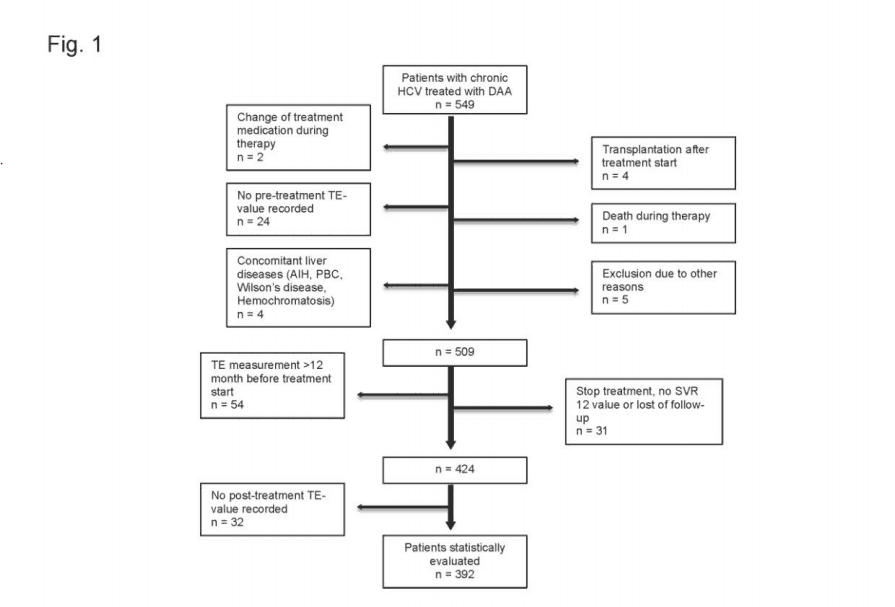
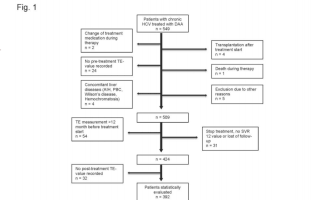
Была произведена оценка пятисот сорока девяти пациентов с ХГС, начавших ПППД-лечение с ноября 2013 по декабрь 2015. Пациенты были отобраны в трех гепатологических центрах в Швейцарии (Цюрих, Лугано, Санкт-Галлен). 496 пациентов получили ПППД-терапию и только 53 пациента получили комбинацию ПЭГ-интерферона и SOF. Сопутствующие заболевания печени и ко-инфекции были зафиксированы там, где это было возможно. Был один случай каждого из следующих: первичный билиарный цирроз, гемохроматоз, аутоиммунный гепатит и болезнь Вильсона, которые были исключены из исследования (рисунок 1).
В нашей группе пациентов 46 пациентов имели ВИЧ-инфекцию, у 5 была инфекция ВГВ и у 1 пациента была ко-инфекция ВИЧ и ВГВ.
Критериями включения были:
- терапия на основе ПППД при хроническом гепатите С,
- наличие данных о результате лечения, включая документированный УВО (определяемый как необнаруживаемая РНК ВГС с помощью ПЦР (анализатор COBAS 4800; Roche Diagnostics, Indianapolis, Indiana, USA) или не-УВО на 12-й неделе,
- действительные измерения TЭ в течение 12 месяцев до начала терапии и в течение 18 месяцев после окончания лечения (EOT),
- до- и послетерапийная лабораторная панель, включая вирусную нагрузку ВГС, генотип и параметры для расчета FIB-4 и APRI,
- пациент информирован о согласии.
Пациенты, которые не соответствовали критериям включения, были исключены из исследования. Большинство исключенных пациентов не имели измерений TЭ до (n=24) или после терапии (n=32) или имели дотерапийное ТЭ-обследование давностью свыше 12 месяцев (n=54).
Один пациент умер во время терапии по несвязанным с этим лечением причинам. Четыре пациента получили трансплантацию печени во время курса лечения. Тридцать один пациент был потерян для наблюдения. Триста девяносто два пациента соответствовали критериям включения и были включены в статистическую оценку.
Противовирусная терапия
Пациенты с хронической инфекцией ВГС начали ПППД-лечение в период между 2014 и 2015 годами, следуя текущим рекомендациям Европейской ассоциации по изучению печени (EASL) и с одобрения швейцарских органов здравоохранения. Четыреста девяносто шесть пациентов получали безинтерфероновую комбинацию ПППД ± рибавирин и 53 пациента — сочетание ПЭГ-интерферона, рибавирина и SOF.
Средняя продолжительность лечения всех пациентов была 15,67 недели. Успешное лечение было определено как отрицательный ПЦР ВГС через 12 недель после окончания лечения (УВО12). Нижний предел обнаружения ВГС ПЦР-анализом был 15 МЕ/мл (COBAS 4800; Roche Diagnostics, Индианаполис, Индиана, США).

Измерение жесткости печени
Измерения жесткости печени (LS) проводили с использованием TЭ (FibroScan, Echosens, Paris, Франция), как описано ранее и в соответствии с текущими гайд-лайнами EASL с использованием откалиброванных датчиков в соответствии с ИМТ (датчик М, если ИМТ<28 кг/м2, датчик XL, если ИМТ≥28 кг/м2).
Предлагаемый график для этого исследования был следующим: измерение ТЭ на исходном уровне (день 0 до ПППД-терапии) и через 12 недель после окончания ППД-лечения. Мы ограничили значения TЭ, включая 12 месяцев до лечения ПППД (медиана 2,5 месяца, диапазон 0-12 месяцев).
Результаты были записаны в килопаскалях (кПа) в диапазоне от 3 до максимального значения 75 кПа. Пациенты голодали не менее 6 часов до ТЭ. Значения для каждого пациента были рассчитаны как медиана минимум 10 последовательных измерений. Для обеспечения качества измерения ТЭ замеры с межквартильным диапазоном (IQR), деленным на среднее значение (IQR/M), >30% или с показателем успешности измерений <60% были исключены в соответствии с рекомендациями производителя и текущими гайд-лайнами,
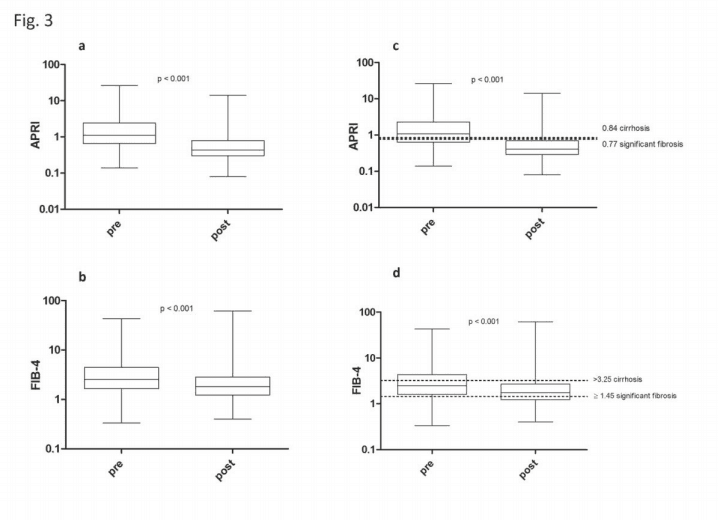
Сывороточные баллы по фиброзу FIB-4 и баллы фиброза APRI были рассчитаны по исходным лабораторным значениям и значениям на момент измерения TЭ, как ранее опубликовано. Пороговые значения значительного фиброза и цирроза печени были приняты из гайд-лайнов EASL для неинвазивной оценки фиброза печени. APRI балл >0,77 был расценен как значительный фиброз, балл >0,84 — как признак цирроза. FIB-4 балл >1,45 указывает на значительный фиброз, значения >3,25 – цирроз.
Характеристики пациентов
Было оценены данные 549 пациентов с ПППД-лечением хронического гепатита С. Пациенты, которые не соответствовали критериям включения, были исключены, как показано на рисунке 1. A всего 392 пациента, проходящих ПППД-лечение инфекции ХВГС и измерениями TЭ, были включены для дальнейшего анализа. Характеристики группы приведены в таблице 1.
В целом, медианное значение TЭ до начала терапии составляло 12,65 кПа (IQR 9,45-19,2 кПа). Пациенты, которые не достигли УВО (n=27) имели значительно (р=0,001) более высокие значения TЭ до начала терапии (медиана 19,40 (IQR 10,8-32,5)), чем пациенты с УВО (n=365) (медиана 12,5 (IQR 9,2-18,2 кПа)). Пятьдесят восемь процентов пациентов до ПППД-лечения были наивными, тридцать пациентов имели сопутствующую ВИЧ-инфекцию, 5 пациентов имели ВГВ-инфекцию и 1 пациент страдал от ВИЧ и ВГВ.
Значение ТЭ значительно уменьшается сразу после успешного ПППД-лечения.
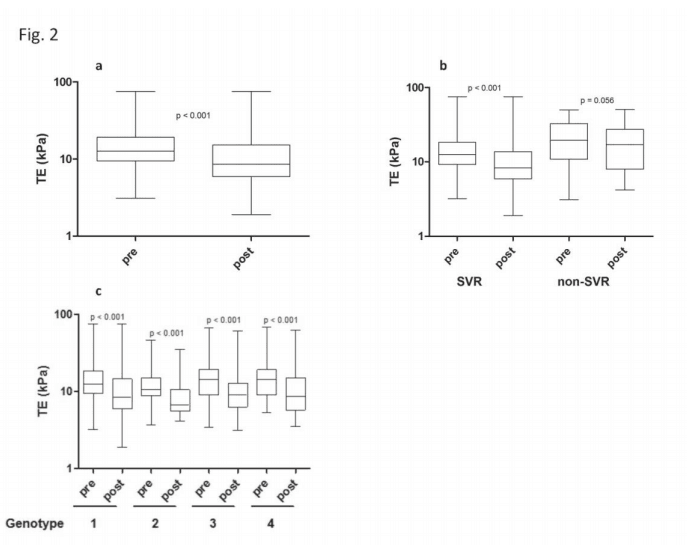
Общие значения TЭ у включенных в исследование пациентов значительно снизились после ПППД-лечения (рисунок 2a) с медианного значения TЭ до лечения 12,65 кПа (IQR 9,45- 19,2 кПа) до медианного значения 8,55 кПа (IQR 5,93-15,25), в основном, в течение 12 недель после лечения.
Относительно результата лечения (УВО в сравнении с не-УВО), только пациенты с УВО показали значительное снижение значений TЭ. Значения TЭ у пациентов без УВО также уменьшались, но не достигли уровня значимости (рисунок 2b). Значительное снижение TЭ после успешной ПППД-терапии не зависело от генотипа ВГС (рис. 2c).
Значения расчета фиброза по сыворотке значительно снизились после УВО, аналогично значениям TЭ.
По аналогии с измерениями TЭ, баллы фиброза по APRI и FIB-4 показали значительное снижение при оценке у всех пациентов, проходящих ПППД-лечение (рис. 3a и b). Более того, снижение показателей фиброза достигло уровня значимости р<0,01 (рис. 3c и d) только у пациентов, достигших УВО. Пациенты, которые не достигли УВО, также имели снижение значений APRI и FIB-4, но оно не было значимым (дополнительные рисунки 1 и 2). Снижение TЭ сохраняется и в повторных измерениях после ПППД-лечения.
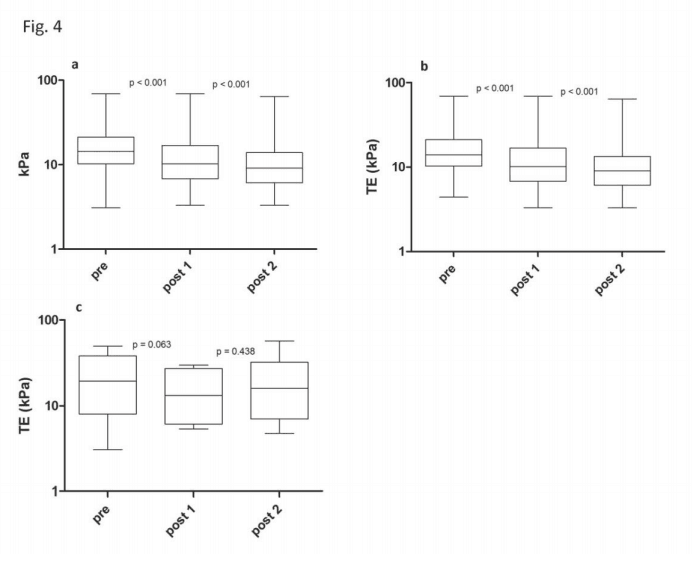
Подгруппа из 143 пациентов с повторными измерениями TЭ после лечения была оценена для подтверждения устойчивого снижения TЭ. Из этих 143 УВО был достигнут у 137 пациентов, в то время как 6 пациентов не имели УВО. Среднее время между окончанием лечения и первым послетерапийным ТЭ было 15 недель, вторым послетерапийным ТЭ – в среднем 40 недель.
Для всех 143 пациентов медианный показатель TЭ до начала терапии был 14,3 кПа (IQR 10,2-21,3). Медиана TЭ в первом послетерапийном измерении составила 10,2 кПа (IQR 6,8-16,9), в то время как медиана TЭ во втором послетерапийном измерении составила 9,1 кПа (IQR 6,1-13,9) (рис. 4а).
Произошло значительное снижение значений между первым и вторым послетерапийными измерениями у 137 пациентов, достигших УВО (р<0,001) (Рисунок 4b). Однако, послетерапийные
значения TЭ у шести пациентов без УВО увеличились с 13,20 кПа (6,15-27,2) до 16,0 кПа (7,05-32,2). Этот вывод не был статистически значимым (р=0,44) (рис. 4c).
Обсуждение
Профилактика развития и уменьшение существующего фиброза печени является основным поводом ПППД-лечения ХГС. Поскольку серии процедур биопсии печени у пациентов с ВГС несут существенный риск осложнений, неинвазивные методы часто используются для оценки фиброза до и после терапии ВГС. Так как наш опыт работы с пациентами и их наблюдения после успешного ПППД-лечения все еще ограничен, значимость предполагаемого снижения фиброза, измеренного неинвазивно, находится вне непосредственного клинического значения. Оценка с помощью TЭ могла бы стать основой для дальнейшего наблюдения и ведения пациентов после эрадикации ВГС.
Как следует из клинического наблюдения, отмечается явное снижение значений TЭ во время или сразу после эрадикации ВГС с помощью ПППД, наше исследование подтверждает это наблюдение в большой группе из 392 пациентов с ХГС, проходивших ПППД-лечение. Среднее медианное время между EOT и послетерапийным ТЭ-измерением – 16,14 недели. В это относительно короткое время после эрадикации ВГС в группе с УВО снижение медианного значения TЭ составило более 30%.
Это приводит к вопросу, отражают ли эти значения TЭ истинную регрессию фиброза или, скорее, уменьшение воспаления и связанных с ними внутритканевых отеков. Более того, в одномерном анализе не было значимой связи между УВО и уменьшением значений TЭ, указывая на то, что даже временное снижение вирусной репликации может быть достаточным для уменьшения жесткости печени, измеренной TЭ.
Вопрос, является ли это снижение устойчивым для пациентов с УВО и без, направлен в подгруппу из 143 пациентов нашего исследования со вторым TЭ-измерением через средне-медианно 9 месяцев после окончания терапии. Выводы из этой подгруппы еще могут быть ограниченными, но произошло дальнейшее значительное снижение значений фиброза между первым и вторым послетерапийными ТЭ-измерениями у пациентов, достигших УВО. У очень небольшой группы пациентов без УВО вместо этого снижения было отмечено незначительное повышение значения во втором послетерапийном ТЭ-измерении, возможно, из-за очень маленького размера этой группы.
В любом случае очевидно, что это требует дальнейшего детального анализа в большей группе пациентов. Такое исследование должно также включать альтернативные неинвазивные методы оценки жесткости печени, такие как МР-эластография, и корреляцию этих неинвазивных результатов с гистологией печени. Включение методов МРТ также позволит провести дальнейшее изучение механизмов регрессии жесткости печени, так MR T1 картирование диффузии и перфузии может помочь дифференцировать регрессию фиброза от простого уменьшения внутритканевого отека после успешного ПППД-лечения, которое может быть трудно различить методом ТЭ.
Общие результаты были сходными для подтвержденных показателей фиброза методами APRI и FIB-4. Как и значения ТЭ, результаты фиброза значительно снизились в течение нескольких недель после эрадикации ВГС. Что касается TЭ, снижение было значительным только у пациентов, достигших УВО, в то время как УВО не было предпосылкой для более низких значений APRI и FIB-4 балла через 12 недель после лечения. Хотя эти результаты продемонстрировали разумную устойчивость к простым изменениям лабораторных значений из-за снижения воспалительной активности, остается открытым вопрос, насколько краткосрочные изменения после ПППД-лечения могут отражать фиброз как предположительно подсчитанный методами APRI и FIB-4.
Что интересно, анализ данных не показал какой-либо существенной разницы между схемами лечения или генотипами ВГС.
Наше исследование имеет ограничения. Прежде всего, моменты времени TЭ до и после лечения не были полностью стандартизированы. Мог бы быть сделан более строгий отбор пациентов по времени TЭ. При условии, что спонтанное значительное уменьшение жесткости печени до какого-либо терапевтического вмешательства маловероятно, мы включили пациентов с TЭ-измерением в течение 12 месяцев до начала терапии. Подобным образом были включены данные в течение 18 месяцев после окончания терапии. Предполагая, что, во всяком случае, мы можем недооценивать реальную регрессию LS в очень ранних измерениях, мы решили включить таких пациентов.
Значительное снижение TЭ в ранние сроки (через 3 месяца после ЕОТ) после терапии, кажется, уже отражает процесс постоянного улучшения, что приводит к дальнейшему значительному снижению жесткости печени при последующем наблюдении до 9 месяцев после EOT. Очевидно, что дальше можно ожидать регресса за пределами этого промежутка времени, особенно учитывая впечатляющие гистологические исследования регресса фиброза спустя годы после успешного лечение ПЭГ-интерфероном. Следовательно, мы планируем продолжить TЭ-наблюдение за нашей группой. Во-вторых, тот же аргумент в отношении моментов времени сбора данных может быть использован для лабораторных значений, используемых для расчета индексов APRI и FIB-4, хотя разбежка во времени значительно меньше для этих значений. Как и раньше, мы решили включить этих пациентов в предположения, описанные выше.
Таким образом, новые схемы лечения с ПППД для ХВГС приводят к быстрому снижению жесткости печени при измерении TЭ. Это изменение значений TЭ, насколько нам известно, не объясняется уменьшением фактического фиброза, так как время кажется слишком коротким для такого значительного восстановления. В то же время, значения фиброза по APRI и FIB-4 отражают эти результаты ТЭ и подчеркивают необходимость дальнейшего изучения методов неинвазивной оценки фиброза после ПППД-лечения. Эти исследования должны также включать альтернативные неинвазивные методы для оценки фиброза печени, такие как МР-эластография, которая может дополнительно помочь лучше охарактеризовать изменения в ткани печени сразу после успешного ПППД-лечения.
После утверждения этого метода для ВГС после ПППД-лечения эти методы будут наиболее ценными инструментами для сопровождения таких пациентов. Помимо этого, дальнейшее наблюдение за нашей группой в отношении долгосрочных печеночных или внепеченочных осложнений из-за хронического гепатита С может усилить аргумент, что каждый
пациент с хроническим гепатитом С должен получить терапию раньше, чтобы в конечном итоге искоренить эту болезнь.
Источник
«DAA treatment of chronic hepatitis C results in rapid regression of transient elastography and fibrosis markers FIB-4 and APRI».
Коллектив авторов
Jacqueline A. Bachofner, Piero V. Valli , Arne Kröger, Irina Bergamin, Patrizia Künzler, Adriana Baserga, Dominique Braun, Burkhardt Seifert, Anja Moncsek, Jan Fehr, David Semela, Lorenzo Magenta, Beat Müllhaupt, Benedetta Terziroli Beretta-Piccoli and Joachim C. Mertens.
Оригинал документа на английском языке
Вопрос-ответ
Что такое безинтерфероновые схемы лечения и как они работают?
Безинтерфероновые схемы лечения представляют собой методы терапии, которые не используют интерфероны для борьбы с вирусом гепатита C. Вместо этого они применяют прямые противовирусные препараты, которые воздействуют на вирус на различных стадиях его жизненного цикла, что позволяет эффективно снижать вирусную нагрузку и улучшать состояние печени.
Каковы основные преимущества безинтерфероновых схем лечения по сравнению с традиционными методами?
Основные преимущества безинтерфероновых схем включают более высокую эффективность, меньшую продолжительность курса лечения, а также значительно меньше побочных эффектов. Это делает лечение более комфортным для пациентов и увеличивает вероятность полного выздоровления.
Как безинтерфероновые схемы лечения влияют на развитие фиброза печени?
Безинтерфероновые схемы лечения могут замедлить или даже остановить прогрессирование фиброза печени, так как они эффективно устраняют вирус из организма. Устранение вируса позволяет печени восстановиться, что может привести к уменьшению фиброза и улучшению функции печени.
Советы
СОВЕТ №1
Обсудите с врачом возможность применения безинтерфероновых схем лечения, если у вас есть предрасположенность к фиброзу. Важно учитывать индивидуальные особенности вашего здоровья и стадию заболевания.
СОВЕТ №2
Регулярно проходите обследования и мониторинг состояния печени. Это поможет своевременно выявить изменения и скорректировать лечение, если это необходимо.
СОВЕТ №3
Обратите внимание на образ жизни: соблюдайте сбалансированную диету, избегайте алкоголя и курения, а также занимайтесь физической активностью. Здоровый образ жизни может значительно улучшить результаты лечения.
СОВЕТ №4
Ищите поддержку в сообществах пациентов, которые проходят аналогичное лечение. Обмен опытом и информацией может помочь вам лучше понять процесс и справиться с возможными трудностями.