Journal of Clinical and Experimental Hepatology. March 2018
Исследование проведено в Индии: Dayanand Medical College, Ludhiana, Punjab.
Внедрение противовирусных препаратов прямого действия (ПППД) быстро изменило методики лечения вируса гепатита C (ВГС) за последние несколько лет. Благодаря более высокой эффективности, безопасности и меньшим побочным эффектам, чем схемы базируемые на интерфероне, ПППД стали стандартом для терапии ВГС.
Различные клинические испытания показали высокие показатели стойкого вирусологического ответа (УВО) после лечения ПППД. В III фазе исследования (ION-1), включавшем в себя лечение 1 генотипа у пациентов с циррозом или без него, комбинированная терапия с помощью Sofosbuvir (SOF) и Ledipasvir (LDV) независимо от рибавирина (RBV) достигала УВО в диапазоне 97-99 %. Показатели УВО увеличились до 99% в обеих группах, когда продолжительность лечения была увеличена до 24 недель. У пациентов с 4 генотипом в исследовании SYNERGY было установлено, что показатель УВО составляет 95% для схемы SOF / LDV + RBV.
Было отмечено, что у пациентов с 3 генотипом относительно низкий уровень ответа. Так в III фазе исследования ALLY-3, применение SOF и Daclatasvir (DCV) без RBV пациенты ранее не проходившие терапию без цирроза получали показатели УВО 97% и 58% у пациентов с циррозом или имевшим опыт неудачного лечения. В исследовании ALLY 3+ проводилась терапия пациентов с развитым фиброзом (METAVIR F3) и циррозом независимо от предыдущего опыта лечения по схеме SOF+DCV+RBV в течение 12 и 16 недель. Показатели УВО у пациентов с развитым фиброзом составляли 100% как после 12, так и после 16 недель терапии, в тоже время пациенты с циррозом имени показатели УВО 83% и 88% при 12- и 16-недельной терапии соответственно.
Поскольку клинические испытания проводятся в контролируемых условиях, полученные результаты не могут быть прямо перенесены на реальные условия. Эффективность препаратов в реальных условиях зависит от многочисленных факторов: соблюдение режима приема лекарств, побочные эффекты приводящие к прекращению приема, характер питания и многих других. Настоящее исследование было проведено для оценки эффективности и безопасности ПППД и оценки воздействия терапии в реальных условиях штата Пенджаб (Индия).
Пациенты и терапия
Терапию проходили большая группа пациентов, в том числе с циррозом, включая тех, кто ранее имел опыт неудачного лечения на основе интерферона. Также были включены пациенты, у которых были совместные инфекции с вирусами гепатита В (ВГВ) или вирусами иммунодефицита человека (ВИЧ). Пациентам с хроническим заболеванием почек не предлагали терапию, поскольку во время проведения данного исследования отсутствовала информация о безопасности ПППД для данной группы пациентов. Другими критериями исключения были прогрессирующее заболевание печени (Child-Turcotte-Pugh CTP> 13 или MELD> 20), тромбоз воротной вены и пациенты с гепатоцеллюлярной карциномой (HCC).
Все пациенты были тщательным образом обследованы. Уровень и соотношение антитела ВГС определяли с помощью ELISA (ELISCAN HCV, RFCL Limited, India), количественную оценку РНК ВГС и определение генотипа в режиме реального времени проводили с помощью RT-PCR (COBAS TaqMan HCV Test 2.0, Roche Diagnostics Corporation, Indianapolis, IN, USA). Также был проведен полный анализ крови, биохимические анализы печени и почек, функции щитовидной железы, индекс протромбинового времени, уровень глюкозы в крови натощак, α-фетопротеин и ультразвуковое исследование органов брюшной полости. Цирроз печени был диагностирован на основании клинических, лабораторных, радиологических, эндоскопических и/или гистологических критериев. В данном исследовании показатели плотности печени более 14,6 кПа (FibroScan®, Echosens, Франция) представляют собой цирроз. Оценки CTP и MELD были рассчитаны для всех пациентов с циррозом.
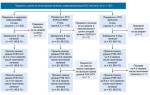
В работе использовались руководство Европейской ассоциации изучения печени (EASL) от 2015 г. Нарушения режима приема препаратов не было в случае, если противовирусные препараты не пропускались в течение двух или более дней подряд. Перечень препаратов для каждого пациента был рассмотрен и согласован двумя независимыми специалистами-консультантами, которые проверили возможное фармакологическое взаимодействие терапии на основе ПППД с другими лекарственными препаратами до начала лечения. Всем пациентам рекомендовалось прекратить применение ингибиторов протонной помпы и проконсультироваться со специалистом перед началом любого другого лечения для оценки потенциального воздействия и взаимного влияния.
| Пациент | Опыт лечения | 1 и 4 генотип | 3 генотип |
| Хронический гепатит | ранее не лечился | SOFa/LDVb 12 недель | SOFa + DCVc 12 недель |
| неудачный опыт предыдущего лечения | SOFa/LDVb 12 недель | SOFa + DCVc + RBVd 12 недель | |
| SOFa + DCVc for 24 weeks if contraindications for use of RBV | |||
| Компенсированный цирроз (CTP A) | ранее не лечился | SOFa/LDVb 12 недель | SOFa + DCVc + RBVd 24 недели |
| неудачный опыт предыдущего лечения | SOFa/LDVb + RBVd for 24 weeks if negative predictors of response | ||
| Декомпенсированный цирроз (CTP B, C up to 12 points) | SOFa/LDVb + RBVd 12 недель | SOFa + DCVc + RBVd 24 недели | |
| SOFa/LDVb for 24 weeks (if contraindications to use of RBV) |
Сокращения:
SOF — Sofosbuvir 400 mg;
LDV — Ledipasvir 90 mg;
DCV — Daclatasvir 60 mg;
RBV — Ribavirin 200 mg. a + b — фиксированная дозировка раз в сутки; a + c — одна таблетка ежедневно; d — RBV согласно массе тела.
Это исследование было одобрено Советом по Медицине и проведено в Медицинском колледже Даянанда на базе государственной клиники Лудхиана (Индия).
Врачи отмечают, что эффективность противовирусной терапии для 1, 3 и 4 генотипов вируса гепатита C значительно варьируется в зависимости от выбранной схемы лечения и индивидуальных особенностей пациента. Для 1 генотипа, который является наиболее распространенным, современные прямые противовирусные препараты демонстрируют высокую степень излечения, достигая 95% и более. В то же время, для 3 генотипа, который часто ассоциируется с более тяжелыми формами заболевания, эффективность терапии может быть ниже, особенно при наличии цирроза печени. Генотип 4, распространенный в некоторых регионах, также поддается лечению с хорошими результатами, однако требует тщательного подбора препаратов. Врачи подчеркивают важность индивидуального подхода к каждому пациенту, что позволяет повысить шансы на успешное лечение и минимизировать риск рецидивов.

Оценка эффективности
Эффективность лечения контролировали спустя 4 недели, в конце терапии (12 или 24 недели) и через 12 недель после окончания лечения для оценки быстрого вирусологического ответа (RVR), завершения ответа на лечение (ETR) и УВО соответственно. Негативный ответ был определен как неспособность достичь ETR, прорыв как появление РНК ВГС в любой момент во время лечения после того как РНК во время терапии была необнаруживаемой, а вирусологический рецидив в случае необнаруживаемой РНК ВГС в конце лечения, но ее обнаружение спустя 12 недель.
Оценка безопасности
Пациенты регулярно наблюдались и следили за любыми неблагоприятными факторами которые могли возникнуть во время физического обследования, клинических и лабораторных исследований. Для пациентов, которым были назначены режимы на основе RBV, контролировали гемоглобин в соответствии с CTCAE, а дозировку постепенно уменьшали на 200 мг каждую неделю, если уровень Hb составлял <10 г/дл, до тех пор, пока значение не увеличилось до 10 г/дл или выше. RBV был отменен у пациентов с уровнем Hb <8,5 г/дл. Дозировка ПППД для всех пациентов была одинаковой и не менялась во время терапии.
Мнения о эффективности противовирусной терапии для 1, 3 и 4 генотипов вируса гепатита C варьируются среди пациентов и специалистов. Многие отмечают значительное улучшение состояния здоровья и высокие показатели излечения, особенно при использовании современных прямых противовирусных средств. Пациенты с 1 генотипом часто сообщают о более высоких шансах на выздоровление, что связано с доступностью новых препаратов. Тем не менее, для 3 и 4 генотипов результаты могут быть менее предсказуемыми, и некоторые пациенты сталкиваются с рецидивами. Важно, что индивидуальный подход к терапии и регулярное наблюдение врача играют ключевую роль в достижении успешного результата. Многие пациенты подчеркивают, что поддержка со стороны медицинских работников и информированность о процессе лечения значительно повышают уверенность в успехе терапии.
Исходные данные пациентов и демография
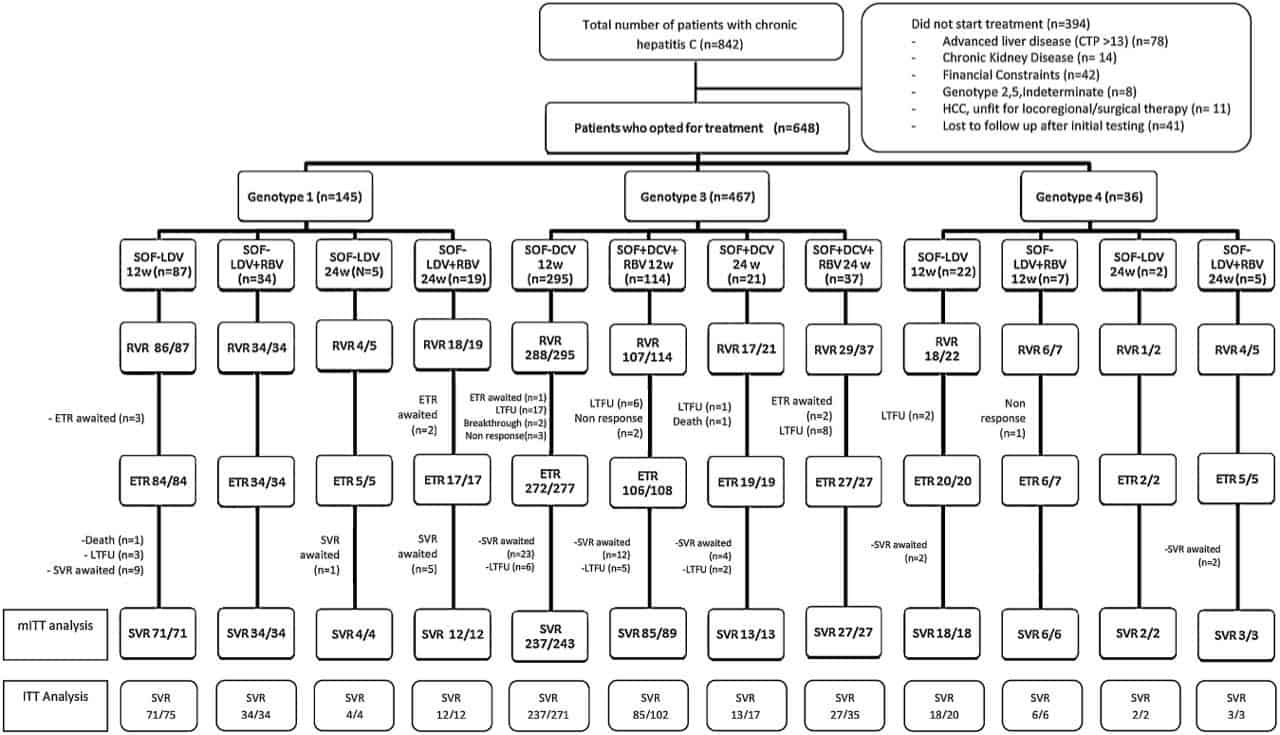
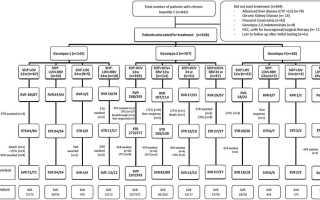
В течение исследования мы оценили данные 842 пациентов с ВГС-инфекцией, из которых 648 (77%) выбрали лечение ПППД (рисунок 1). Средний возраст составил 43,7 ± 14,1 года, большинство пациентов были мужчины (n = 424, 65,4%), в возрастной группе 41-60 лет (n = 320, 49,4%). Пациенты чаще всего инфицировались генотипом 3 (n = 467, 72,1%), а генотип 1 (n = 145, 22,4%) и 49,7% (n = 320) имел высокую вирусную нагрузку. 25,6% пациентов ранее злоупотребляли алкоголем. Иньекционное употребление наркотических средств отмечено у 51 (7,9%) пациентов. Цирроз присутствовал у 271 пациентов (41,8%), и среди них большая часть была компенсирована (n = 159, 58,7%). Коинфекция с ВГВ была отмечена у 5 пациентов, а у три пациента были реципиентами почки после трансплантации.
Неблагоприятные события
Хотя у нескольких пациентов наблюдались незначительные побочные эффекты, ни один из них не прекращал терапию из-за непереносимости препаратов или побочных эффектов. Как правило, наблюдались усталость и анемия (у 53 пациентов — 8,3%), и они чаще всего встречались у пациентов в случае использования RBV.

Дискуссия
Внедрение ПППД в течение последних нескольких лет произвело революцию в лечении хронического гепатита С. Хотя в различных исследованиях III фазы сообщалось о высокой эффективности и безопасности данных методов лечения результаты необходимо оценивать в реальных условиях, на которые могут повлиять соблюдение пациентом режима приема, сопутствующие заболевания и многие другие факторы влияющие на достижение УВО. В нашем исследовании мы мы провели анализ применения в реальных условиях при лечении 1, 3 и 4 генотипов.
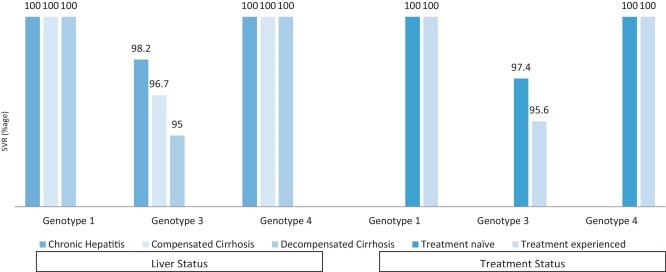
В целом, показатели УВО12 были достигнуты в 98,1% (88,1% при анализе ITT). Показатель УВО12 для 1 и 4 генотипа составил 100%, а для 3 генотип — 97,3% (mITT). Полученные показатели УВО были выше, чем в исследованиях III фазы и других исследованиях в реальных условиях. Частота ответов была неизменно высокой у всех пациентов, независимо от состояния печени или используемой терапевтической схемы. Не было зафиксировано никаких серьезных побочных эффектов которые обусловили бы прекращение терапии, хотя в некоторых случаях добавление RBV у пациентов с прогрессирующим заболеванием печени вызывало анемию (53 пациентов — 8,3%) и требовало коррекцию в сторону снижения дозировки.
Полученный опыт показал высокие показатели УВО12 (91-98%) у пациентов, получавших SOF/LDV не зависимо от RBV у пациентов с 1 генотипом, включая пациентов с циррозом и у тех, кто имел опыт неудачной терапии проведенной ранее. Объективные данные о эффективности SOF/DCV у пациентов с 3 и 4 генотипами в реальных условиях недостаточны. Так, в недавно завершенном открытом многоцентровом исследовании проведенном во Франции показатель УВО12 у пациентов с 3 генотипом, получавших SOF / DCV независимо от RBV, был определен на уровне 89%. В большой европейской программе была оценена эффективность DCV на основе данных 485 пациентов из 100 медицинских центров в Германии, Австрии, Нидерландах, Швеции и Норвегии в период с апреля 2014 года по апрель 2015 года. У ста двух пациентов был 3 генотип, у 85% из них был цирроз (52% с декомпенсацией) — после проведенного лечения с помощью SOF+DCV независимо от RBV, показатель УВО12 был достигнут у 88%. В другом многоцентровом исследовании проведенный в Испании для того же генотипа и схемы лечения показатель УВО составил 94%.
Наше исследование показало более высокие показатели УВО12 в генотипах 1, 3 и 4 по сравнению с испытаниями III фазы и опытом реального применения препаратов в Европе. Возможные причины более высокого УВО могут быть связаны как с особенностью ВГС в данной местности, так и с факторами, связанными непосредственно с пациентами. Число пациентов с коинфекцией ВГВ было меньше чем в Европейских, кроме того в нашем исследовании не было ни одной коинфекции ВИЧ. Большая доля пациентов с 1b генотипом, которые, как считается, имеют лучший терапевтический ответ на ПППД. Кроме того, мы отмечали более высокую распространенность субгенотипа 3а и у этих пациентов был получен хороший ответ на терапию. Высокие показатели УВО также можно было отнести к большей доле пациентов без цирроза.
Наше исследование также представляет собой первый опыт применения в реальных условиях ПППД для лечения 4 генотипа при использовании SOF/LDV независимо от RBV в азиатском регионе. Показатель УВО12 у данной группы пациентов (включая пациентов с циррозом и пациентов с неудачным опытом предыдущего лечения) составил 100%. Хотя число пациентов с генотипом 4 было небольшим, эти результаты подтверждают эффективность данного назначения, что соотноситься с результатами клинических испытаниях.
К данному исследованию есть несколько важных замечаний: оно было центральным и проводилось в одной клинике, субтипирование для первого генотипа не проводилось у 43% пациентов, число пациентов с 4 генотипом было небольшим.
В заключении хотим отметить, что полученные нами данные показывают эфективность и безопасность терапии на основе ПППД и имеют высокий уровень успеха при лечении пациентов с генотипами 1, 3 и 4 ВГС-инфекции в реальных условиях. При этом нет явной зависимости от состояния печени пациента и негативного опыта предыдущего лечения. Наличие возможности применять двухкомпонентные схемы ПППД по заведомо низким ценам, имеющим низкие показатели основных частоты возникновения побочных эффектов, легкость приема, привело к серьезному улучшению прогнозов результативности терапии.
Более низкая стоимость терапии основе SOF, по сравнению со странами Европы и США, и меньшее количество побочных эффектов обеспечили приемлемость данной методики лечения в развивающихся странах, таких как Индия.
Источник:
Journal of Clinical and Experimental Hepatology. Volume 8, Issue 1, March 2018 , Pages 7-14
Коллектив авторов:
VarunMehta, RamitMahajan, VandanaMidha, VikramNarang, KirandeepKaur, ArshdeepSingh, AnandMalhotra, AslamParvez, AjitSood.
Вопрос-ответ
Как лечить гепатит с 3 генотипом?
Для пациентов с 3 генотипом рекомендуемая схема лечения включает софосбувир в сочетании с рибавирином (дозировка последнего в зависимости от веса) в течение 24 недель. Альтернативная схема лечения – софосбувир в сочетании с рибавирином и пегилированными интерферонами в течение 12 недель.
Что такое генотип 3?
Гепатит С генотип 3а — одна из распространённых форм, которая может влиять на функции печени. Проявляется через общую слабость, снижение аппетита и дискомфорт в правом подреберье. Без терапии возможны переход в хроническую форму и потеря уровня энергии.
Какой генотип гепатита С легче поддается лечению?
ВГС генотипов 2 и 3 менее агрессивен и легче поддается лечению. ВГС генотипов 4, 5 и 6 в России практически не встречается.
Что означает гепатит с генотипом 1b?
Считается, что генотип 1b является более устойчивым к противовирусной терапии и вызывает развитие заболевания с более высоким риском перехода заболевания в хроническую форму.
Советы
СОВЕТ №1
Перед началом противовирусной терапии обязательно проконсультируйтесь с врачом. Он поможет определить наиболее подходящий режим лечения в зависимости от вашего генотипа вируса и общего состояния здоровья.
СОВЕТ №2
Регулярно проходите контрольные обследования во время и после терапии. Это позволит отслеживать эффективность лечения и при необходимости корректировать его.
СОВЕТ №3
Обратите внимание на возможные побочные эффекты препаратов. Заранее обсудите с врачом, как их минимизировать и что делать в случае их появления.
СОВЕТ №4
Соблюдайте режим приема лекарств и не пропускайте дозы. Это критически важно для достижения максимальной эффективности терапии и предотвращения развития резистентности вируса.