По данным Государственного реестра лекарственных средств, на данный момент на территории РФ проходит 31 клиническое исследование (КИ) препаратов для лечения ВИЧ-инфекции, гепатита С и туберкулеза. Общее количество пациентов, принимающих участие в исследованиях, составляет 2033 человека.
В частности, в реестре найдено 18 исследований препаратов для лечения ВИЧ-инфекции (988 пациентов), из них:
- Одно КИ исследование посвящено сопоставимости эффективности, безопасности и переносимости инновационного препарата каботегравир длительного действия, применяемого в комбинации с рилпивирином длительного действия каждые 8 недель или каждые 4 недели у взрослых инфицированных ВИЧ-1 пациентов с вирусологической супрессией.
- 17 исследований по изучению биоэквивалентности/фармакокинетики и биоэквивалентности монокомпонентов (дарунавир, атазанавир, эфавиренз, ралтегравир), а также комбинированных препаратов (абакавир/ламивудин, тенофовир/эмтрицитабин, ламивудин/тенофовир/эфавиренз, тенофовир/эмтрицитабин/эфавиренз).
Более детально об исследованиях — в таблице:
| Наименование | Организация, проводящая КИ | Окончание (дата) | Протокол |
| Каботегравир (GSK1265744А),Каботегравир (GSK1265744B) |
ВииВ ХЕЛСКЕР ТРЕЙДИНГ СЕРВИСЕС ЮК ЛИМИТЕД | 25.08.2020 | Многоцентровое открытое рандомизированное исследование в параллельных группах IIIb фазы с целью проверки гипотезы о сопоставимости эффективности, безопасности и переносимости каботегравира длительного действия, применяемого в комбинации с рилпивирином длительного действия каждые 8 недель или каждые 4 недели у взрослых инфицированных ВИЧ-1 пациентов с вирусологической супрессией |
| Дарунавир | Акционерное общество «КРКА, фармацевтический завод, д.д. Ново Место» | 20.10.2018 | Сравнительное фармакокинетическое исследование биоэквивалентности препарата дарунавир (дарунавир, 800 мг, таблетки, покрытые пленочной оболочкой, АО «КРКА д. д., Ново место», Словения) и препарата Презиста® (дарунавир, 800 мг, таблетки, покрытые пленочной оболочкой, ООО «Джонсон & Джонсон», Россия) после однократного перорального приема здоровыми добровольцами женского и мужского пола после приема пищи |
| Атазанавир | Сан Фармасьютикал Индастриз Лимитед | 20.03.2019 | Открытое рандомизированное перекрестное, двухэтапное с двумя последовательностями одноцентровое сравнительное исследование фармакокинетики и биоэквивалентности препаратов «Атазанавир», капсулы, 300 мг, производства компании Сан Фармасьютикал Индастриз Лимитед, Индия, и «Реатаз®», капсулы, 300 мг, производства компании «АстраЗенека Фармасьютикалз ЛП», США, у здоровых добровольцев после еды |
| Абакавир + Ламивудин | Сан Фармасьютикал Индастриз Лимитед | 31.12.2018 | Открытое рандомизированное перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препарата Абакавир + Ламивудин, таблетки, покрытые пленочной оболочкой, 600 мг + 300 мг (Сан Фармасьютикал Индастриз Лимитед, Индия) и препарата Кивекса, таблетки, покрытые пленочной оболочкой, 600 мг + 300 мг (ВииВ Хелскер Великобритания Лимитед, Великобритания) с участием здоровых добровольцев |
| BCD-049 (Тенофовир + эмтрицитабин + эфавиренз, Тенофовир + эмтрицитабин + эфавиренз) | ЗАО «БИОКАД» | 31.12.2019 | Открытое рандомизированное перекрестное исследование биоэквивалентности препарата BCD-049 (ЗАО «БИОКАД», Россия) и Атрипла® у здоровых добровольцев при однократном пероральном приеме натощак |
| Атазанавир-ТЛ (Атазанавир) | ООО «Технология лекарств» | 01.02.2018 | Открытое, рандомизированное, перекрестное, репликативное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Атазанавир-ТЛ капсулы 300 мг (ООО «Технология лекарств», Россия) и Реатаз® капсулы 300 мг (Бристол-Майерс Сквибб Компани, США) с участием здоровых добровольцев |
| Дарунавир Канон (Дарунавир) | ЗАО «Канонфарма продакшн» | 31.12.2018 | Проспективное открытое рандомизированное перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Дарунавир Канон, таблетки, покрытые пленочной оболочкой, 800 мг («ЗАО «Канонфарма продакшн», Россия) и Презиста®, таблетки, покрытые пленочной оболочкой, 800 мг (ООО «Джонсон & Джонсон», Россия) при их применении в комбинации с низкой дозой ритонавира у здоровых добровольцев после приема пищи |
| Саквинавир-ТЛ (Саквинавир) | ООО «Технология лекарств» | 01.03.2018 | Открытое, рандомизированное, перекрестное, репликативное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Саквинавир-ТЛ таблетки, покрытые пленочной оболочкой 500 мг (ООО «Технология лекарств», Россия) и Инвираза® таблетки, покрытые оболочкой 500 мг (Ф.Хоффманн-Ля Рош Лтд, Швейцария) с участием здоровых добровольцев |
| Дарунавир | Научно-производственный центр «Фармзащита» Федерального медико-биологического агентства | 31.12.2018 | Проспективное открытое рандомизированное перекрестное исследование по изучению сравнительной фармакокинетики и биоэквивалентности препаратов Дарунавир, таблетки, покрытые пленочной оболочкой, ФГУП НПЦ «Фармзащита» ФМБА России и Презиста® (дарунавир), таблетки, покрытые пленочной оболочкой, ООО «Джонсон & Джонсон» (Россия) у здоровых добровольцев |
| Атазанавир (Атазанавира сульфат) | ООО «Атолл» | 31.12.2020 | Проспективное, открытое, рандомизированное, перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препарата Атазанавир, капсулы, 300 мг (ООО «Озон», Россия), в сравнении с препаратом Реатаз®, капсулы, 300 мг («АстраЗенека Фармасьютикалз ЛП», США), у здоровых добровольцев |
| Атазанавир | ООО «ИРВИН 2» | 01.08.2018 | Открытое рандомизированное трехпериодное перекрестное сравнительное исследование фармакокинетики и биоэквивалентности препаратов Атазанавир, капсулы, 200 мг (ООО «ИРВИН 2», Россия) и Реатаз®, капсулы, 200 мг (Бристол-Майерс Сквибб Компани, США), с участием здоровых добровольцев при приеме после еды |
| Эфавиренз | Общество с ограниченной ответственностью «МБА-групп» | 03.07.2018 | Проспективное открытое рандомизированное перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Эфавиренз , таблетки, покрытые пленочной оболочкой, 600 мг (ООО «МБА-групп», Россия) и Стокрин, таблетки, покрытые пленочной оболочкой, 600 мг (Мерк Шарп и Доум Б.В., Нидерланды) у здоровых добровольцев натощак |
| Эфавиренз-ТЛ (Эфавиренз) | ООО «Технология лекарств» | 31.12.2018 | Открытое, рандомизированное, перекрестное, исследование сравнительной фармакокинетики и биоэквивалентности препаратов Эфавиренз-ТЛ таблетки, покрытые пленочной оболочкой, 600 мг (ООО «Технология лекарств», Россия) и Стокрин® таблетки, покрытые пленочной оболочкой 600 мг (Мерк Шарп и Доум, Б.В., Нидерланды) с участием здоровых добровольцев |
| Ламивудин + Тенофовир + Эфавиренз | Акционерное общество «Фармасинтез» | 30.05.2018 | Открытое рандомизированное перекрестное исследование сравнительной фармакокинетики и биоэквивалентности комбинированного препарата Ламивудин+Тенофовир+Эфавиренз (МНН: ламивудин + тенофовир + эфавиренз) таблетки, покрытые пленочной оболочкой 300 мг+300 мг+600 мг (АО «Фармасинтез», Россия) и трех монокомпонентных препаратов: Эпивир® (МНН: ламивудин), таблетки, покрытые пленочной оболочкой, 150 мг («ВииВ Хелскер Великобритания Лимитед», Великобритания); Виреад® (МНН: тенофовир), таблетки, покрытые пленочной оболочкой, 300 мг («Гилеад Сайенсиз Интернешнл Лтд», Великобритания); Стокрин® (МНН: эфавиренз), таблетки, покрытые пленочной оболочкой, 600 мг («Мерк Шарп и Доум Б.В.», Нидерланды) у здоровых добровольцев после однократного приема натощак |
| Дарунавир | ООО «ИРВИН 2» | 31.12.2018 | Открытое, рандомизированное, одноцентровое, перекрестное исследование сравнительной фармакокинетики, биоэквивалентности и безопасности препаратов Дарунавир, таблетки, покрытые пленочной оболочкой, 800 мг (ООО «ИРВИН 2», Россия, производство ЗАО «ЗиО-Здоровье», Россия) и Презиста®, таблетки, покрытые пленочной оболочкой, 800 мг («Держатель регистрационного удостоверения ООО «Джонсон & Джонсон», Россия, производство «Янссен-Орто ЛЛС», Пуэрто-Рико) при их применении в комбинации с низкой дозой ритонавира у здоровых добровольцев |
| Тенофовир + Эмтрицитабин | ЗАО «Канонфарма продакшн» | 18.04.2019 | Проспективное, открытое, рандомизированное, перекрестное, сравнительное исследование фармакокинетики и биоэквивалентности лекарственных препаратов Тенофовир + Эмтрицитабин, таблетки, покрытые пленочной оболочкой 300мг + 200мг (ЗАО «Канонфарма продакшн», Россия) и Трувада®, таблетки, покрытые пленочной оболочкой, 300мг + 200 мг (Гилеад Сайенсиз Интернешнл Лтд, Великобритания) у здоровых добровольцев с однократным приемом внутрь натощак |
| Абакавир + Ламивудин | ЗАО «Канонфарма продакшн» | 15.11.2019 | № 10/17 «Проспективное, открытое, рандомизированное, перекрестное, сравнительное исследование фармакокинетики и биоэквивалентности лекарственных препаратов Абакавир+Ламивудин, таблетки, покрытые пленочной оболочкой 600+300 мг (ЗАО «Канонфарма продакшн», Россия) и Кивекса таблетки, покрытые пленочной оболочкой 600+300 мг, производства «Глаксо Оперэйшенс Великобритания Лтд», Великобритания у здоровых добровольцев с однократным приемом внутрь натощак» |
| Ралтегра (Ралтегравир) | Акционерное общество «Фармасинтез» | 30.09.2019 | Открытое, рандомизированное, перекрестное четырехэтапное исследование сравнительной фармакокинетики и относительной биодоступности препарата Ралтегра (ралтегравир), таблетки покрытые пленочной оболочкой 400 мг (АО «Фармасинтез», Россия) и Исентресс® (ралтегравир), таблетки покрытые пленочной оболочкой 400 мг («Мерк Шарп и Доум Б.В.», Нидерланды; производитель «МСД Интернешнл ГМБх» (Сингапур Бранч), Сингапур) у здоровых добровольцев |
Найдена информация о 8 исследованиях препаратов для лечения гепатита С (559 пациентов), из них:
- 4 КИ по оценке по оценке (фармакокинетики)/эффективности и безопасности оригинальных препаратов (глекапревир/пибрентасвир, гразопревир/рузасвир/уприфосбувир),
- 2 КИ по исследованию (фармакокинетики)/биоэквивалентности препарата софосбувир,
- 2 КИ по исследованию препарата нарлапревир (в комбинации с ритонавиром и софосбувиром и с ритонавиром и даклатасвиром).
Врачи отмечают, что клинические исследования препаратов против ВИЧ, вирусного гепатита C (ВГС) и туберкулеза (ТБ) играют ключевую роль в борьбе с этими заболеваниями. Они подчеркивают важность разработки новых антиретровирусных средств и противовирусных терапий, которые могут значительно улучшить качество жизни пациентов и снизить уровень заболеваемости. Специалисты также акцентируют внимание на необходимости многоуровневого подхода к лечению, включая не только медикаментозную терапию, но и социальную поддержку. Врачи уверены, что успешные клинические испытания могут привести к созданию более эффективных схем лечения, что, в свою очередь, поможет в достижении глобальных целей по искоренению этих инфекций. Кроме того, они подчеркивают важность участия пациентов в исследованиях, что позволяет не только улучшить терапию, но и повысить уровень осведомленности о заболеваниях.

Более детально — в таблице ниже:
| Наименование | Организация, проводящая КИ | Окончание (дата) | Протокол |
| Глекапревир (GLE)/Пибрентасвир (PIB) (АВТ-493/АВТ-530) | ЭббВи Инк. | 31.12.2020 | Открытое исследование с одной группой по оценке эффективности и безопасности Глекапревира (GLE)/Пибрентасвира (PIB) у пациентов с хроническим гепатитом С генотипа 1,2,4,5 или 6 и компенсированным циррозом, ранее не получавших лечения |
| АВТ-493 (Глекапревир)/АВТ-530 (Пибрентасвир) | ЭббВи Инк. | 20.02.2023 | Открытое, многоцентровое исследование по оценке фармакокинетики, безопасности и эффективности глекапревира/ пибрентасвира у пациентов детского возраста, с хронической инфекцией вирусом гепатита С (ВГС), генотипа 1-6 |
| MK-3682B (Гразопревир МК-5172 + Рузасвир МК-8408 + Уприфосбувир МК-3682) | Мерк Шарп и Доум Корп. (подразделение компании Мерк и Ко. Инк.) | 31.12.2019 | Клиническое исследование III фазы с целью оценки эффективности и безопасности комбинированного режима терапии препаратом MK-3682B (Гразопревир (Grazoprevir)/Рузасвир (Ruzasvir)/Уприфосбувир (Uprifosbuvir)) у пациентов с хроническим вирусным гепатитом C генотипа 3 |
| АВТ-493/АВТ-530 (Глекапревир/Пибрентасвир) | ЭббВи Инк. | 13.06.2019 | Открытое, многоцентровое исследование c одной группой по оценке эффективности и безопасности глекапревира (GLE)/ пибрентасвира (PIB) у пациентов с хронической инфекцией вирусом гепатита С (ВГС) генотипа 1-6, ранее не получавших лечения, и соотношением уровня аспартатаминотрансферазы к уровню тромбоциов (APRI) ≤ 1 |
| Софосбувир-натив (Софосбувир) | ООО «Натива» | 01.11.2018 | Открытое рандомизированное перекрестное четырехэтапное одноцентровое сравнительное с четырьмя этапами и двумя последовательностями исследование фармакокинетики и биоэквивалентности препаратов «Софосбувир-натив», таблетки 400 мг, производства OOO «Натива», Россия, и «Совальди®», таблетки 400 мг, производства «Гилеад Сайенсиз Интернешнл Лимитед», Великобритания, у здоровых добровольцев после однократного приема натощак |
| Софосбувир | Акционерное общество «Фармасинтез» | 30.06.2018 | Открытое рандомизированное перекрестное повторное четырёхэтапное одноцентровое сравнительное исследование биоэквивалентности препаратов Софосбувир таблетки, покрытые плёночной оболочкой 400 мг (АО «Фармасинтез», Россия) и Совальди® таблетки, покрытые плёночной оболочкой 400 мг (Гилеад Сайенсиз Интернешнл Лимитед, Великобритания) у здоровых добровольцев после приёма пищи |
| Нарлапревир | АО «Р-Фарм» | 30.04.2018 | Эффективность и безопасность пероральной комбинированной терапии препаратами Нарлапревир/Ритонавир и Софосбувир у пациентов с хроническим гепатитом С (генотип 1), не получавших ранее лечение |
| Нарлапревир | АО «Р-Фарм» | 31.01.2019 | Эффективность и безопасность пероральной комбинированной терапии препаратами Нарлапревир/Ритонавир и Даклатасвир у пациентов с хроническим гепатитом С (генотип 1B), не получавших ранее лечение |
Также найдена информация о 5 КИ препаратов для лечения туберкулеза, из них:
- 1 КИ по оценке безопасности и эффективности разных доз и разной продолжительности лечения линезолидом в сочетании с бедаквилином и претоманидом у пациентов со ШЛУ ТБ, пре-ШЛУ ТБ либо МЛУ ТБ — при непереносимости лечения либо устойчивости к лечению,
- 1 КИ эффективности, безопасности и фармакокинетики (препарат PBTZ169),
- 1 КИ фармакокинетики и биоэквивалентности препарата ПАСК-Акри® (аминосалициловая кислота),
- 1 исследование 2а фазы противотуберкулезной вакцины ТВ/FLU-04L.
Клинические исследования препаратов против ВИЧ, ВГС и ТБ вызывают широкий спектр мнений и эмоций среди людей. Многие пациенты и их семьи выражают надежду на новые методы лечения, которые могут значительно улучшить качество жизни и продлить её. Участие в таких исследованиях воспринимается как шанс на выздоровление и возможность внести вклад в науку. Однако не обходит стороной и страх перед возможными побочными эффектами и недостаточной эффективностью новых препаратов. Некоторые участники исследований отмечают важность информирования о рисках и преимуществах, чтобы сделать осознанный выбор. В то же время, врачи и исследователи подчеркивают, что без клинических испытаний невозможно разработать безопасные и эффективные лекарства. Обсуждения на форумах и в социальных сетях показывают, что общество активно интересуется вопросами этики, доступа к лечению и будущего борьбы с этими заболеваниями.
Больше информации — в таблице ниже:
| Наименование | Организация, проводящая КИ | Окончание (дата) | Протокол |
| Бедаквилин, Претоманид, Линезолид | Корпорация «Глобальный альянс по разработке лекарств от туберкулеза» (The Global Alliance for TB Drug Development, INC.) | 31.12.2021 | Частично слепое рандомизированное исследование 3 фазы для оценки безопасности и эффективности разных доз и разной продолжительности лечения линезолидом в сочетании с бедаквилином и претоманидом у пациентов с легочной инфекцией: туберкулез с широкой лекарственной устойчивостью (ШЛУ ТБ), пре-ШЛУ ТБ либо туберкулез с множественной лекарственной устойчивостью (МЛУ ТБ) — при непереносимости лечения либо устойчивости к лечению (ZeNix) |
| ПАСК (Аминосалициловая кислота) | АО «ВЕРТЕКС» | 20.09.2019 | Открытое, рандомизированное, перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препаратов ПАСК таблетки, покрытые кишечнорастворимой оболочкой 1000 мг (АО «ВЕРТЕКС», Россия) и ПАСК таблетки, покрытые кишечнорастворимой оболочкой 1000 мг (ОАО «Фармасинтез», Россия) с участием здоровых дорбровольцев натощак |
| ПАСК-Акри® (Аминосалициловая кислота) | Акционерное общество «Химико-фармацевтический комбинат «АКРИХИН» (АО «АКРИХИН») | 01.10.2018 | Открытое, рандомизированное, перекрестное двухэтапное с адаптивным дизайном исследование сравнительной фармакокинетики и биоэквивалентности препаратов ПАСК-Акри®, таблетки кишечнорастворимые, покрытые пленочной оболочкой, 500 мг (АКРИХИН) и ПАСК-Акри®, таблетки кишечнорастворимые, покрытые пленочной оболочкой, 1000 мг (АКРИХИН), с участием здоровых добровольцев натощак |
| ТВ/FLU-04L (вакцина туберкулезная культуральная живая векторная) | Республиканское государственное предприятие на праве хозяйственного ведения «Научно-исследовательский институт проблем биологической безопасности» Комитета науки Министерства образования и науки Республики Казахстан | 30.05.2018 | Рандомизированное, двойное слепое, плацебо-контролируемое клиническое исследование 2а фазы противотуберкулезной вакцины ТВ/FLU-04L у взрослых добровольцев с признаками латентной туберкулезной инфекции |
| PBTZ169 | ООО «НИАРМЕДИК ПЛЮС» | 01.03.2020 | Международное многоцентровое двойное слепое плацебо-контролируемое рандомизированное исследование для оценки эффективности, безопасности и фармакокинетики препарата PBTZ169 при применении в комплексной терапии у пациентов с туберкулезом органов дыхания с бактериовыделением и лекарственной устойчивостью |

Вопрос-ответ
Каковы основные этапы клинических исследований препаратов против ВИЧ, ВГС и ТБ?
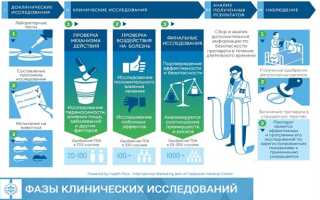
Клинические исследования обычно делятся на несколько этапов: фаза I (безопасность и дозировка), фаза II (эффективность и побочные эффекты), фаза III (сравнение с существующими методами лечения) и фаза IV (последующий мониторинг после выхода на рынок). Каждый этап включает в себя строгие протоколы и контроль за участниками, чтобы обеспечить надежность данных.

Какие факторы влияют на успешность клинических испытаний против инфекционных заболеваний?
Успех клинических испытаний зависит от множества факторов, включая выбор подходящей популяции участников, качество разработки препарата, наличие эффективных методов мониторинга и оценки результатов, а также соблюдение этических норм и стандартов. Также важна поддержка со стороны научного сообщества и финансирование исследований.
Какова роль пациентов в клинических исследованиях?
Пациенты играют ключевую роль в клинических исследованиях, так как именно они являются участниками испытаний. Их согласие на участие, соблюдение протоколов и предоставление обратной связи о переносимости и эффективности лечения помогают исследователям оценить реальное воздействие препарата. Кроме того, вовлечение пациентов в процесс может повысить доверие к исследованиям и улучшить их результаты.
Советы
СОВЕТ №1
Изучите информацию о текущих клинических исследованиях, связанных с ВИЧ, ВГС и ТБ. Это поможет вам быть в курсе последних достижений в области медицины и новых методов лечения, которые могут быть доступны в будущем.
СОВЕТ №2
Обсудите с вашим врачом возможность участия в клинических испытаниях. Врач может предоставить информацию о текущих исследованиях и помочь вам понять, подходит ли вам участие в них.
СОВЕТ №3
Обратите внимание на этические аспекты клинических исследований. Убедитесь, что вы понимаете все риски и преимущества, а также процесс получения информированного согласия перед участием в любом исследовании.
СОВЕТ №4
Следите за новостями и публикациями в научных журналах, чтобы быть в курсе последних результатов клинических испытаний. Это поможет вам лучше понять эффективность новых препаратов и их влияние на здоровье.