Введение
По примерным оценкам, во всем мире более 71 миллион человек инфицированы вирусом гепатита С (ВГС), а ежегодное число смертей, связанных с циррозом печени и гепатоцеллюлярной карциномой, составляет около 400 тысяч. Важным клиническим аспектом гепатита С, наблюдаемым примерно у 85% пациентов, является высокий уровень прогрессирования ассоциированных с ним хронических заболеваний. При этом, у значительной части пациентов наблюдается высокий риск развития фиброза печени, что в конечном итоге приводит к циррозу и гепатоцеллюлярной карциноме (ГЦК). Сегодня ВГС классифицируется по семи генотипам (1–7) и 67 подтипам. Наиболее распространенными подтипами в странах Европы и Северной Америки являются 1a и 1b.
До 2011 года терапия хронического гепатита С основывалась на различных вариантах комбинации пегилированного интерферона и рибавирина (пег-ИФН / РБВ — длительному лечению, которое, помимо тяжелых нежелательных побочных эффектов, не давало однозначно обнадеживающих результатов достижения устойчивого вирусологического ответа (УВО). В связи с этим, в центре внимания исследователей и разработчиков лекарственных средств последнего десятилетия стало создание препаратов прямого противовирусного действия (ПППД). Современные достижения по изучению жизненного цикла вируса в линиях клеточных культур стали важной вехой в понимании механизмов функционирования и проникновения ВГС.
Среди основных мишеней для ПППД — сериновая протеаза NS3 ВГС, белок, который образует нековалентный комплекс с NS4A и отвечает за расщепление неструктурной части транслированного вирусного полипротеина.
В 2013 году препараты первой волны и первого поколения, Телапревир и Боцепревир, были первыми ингибиторами протеаз (ИП), включенными в бразильское клиническое руководство по лечению пациентов инфицированных 1 генотипом ВГС. Основываясь на этом клиническом руководстве 2013 года, Телапревир можно использовать для всех групп пациентов, в тоже время Боцепревир был показан только для пациентов с прогрессирующим фиброзом METAVIR F3-F4 проходившим терапию впервые. Его сочетание с пег-ИФН / РБВ привело к росту частоты достижения УВО до 75%. Тем не менее, значительная частота возникновения побочных эффектов и неудовлетворительная эффективность в отношении 1 генотипа четко обусловили необходимость разработки новых соединений нацеленных на ингибирование разных вирусных белков. Совсем недавно в клиническое руководство были включены и могут применяться новые препараты, которые можно назначать без сильного влияния со стороны анамнеза пациента.
На 2015 год для клинического применения в Бразилии были одобрены: Симепревир, препарат второй волны NS3/4A ИП первого поколения, Даклатасвир (ингибитор NS5A) и Софосбувир (ингибитор полимеразы NS5B). Различные сочетания данных препаратов, по сравнению с препаратами первой волны, позволяет существенно расширить терапевтическое покрытие, по крайней мере на 1, 2 и 4 генотипы ВГС. Совсем недавно (2017 год) в Бразилии были лицензированы Паритапревир в комбинации с Омбитасвиром, Ритонавиром и Дасабувиром для лечения пациентов подтипа 1a без цирроза и для пациентов подтипа 1b с компенсированным циррозом печени (Чайлд-Пью A). ИП второго поколения, Гразопревир совместно с Эльбасвиром, был включен в клинический протокол для пациентов, инфицированных 1 и 4 генотипом ВГС. Пангенотипические ИП, такие как Глекапревир и Воксилапревир, на данный момент еще не прошли регистрацию в бразильском системе администрации лекарственных средств, однако представляют многообещающую альтернативу для широкой группы пациентов, независимо от наличия цирроза печени и опыта предыдущего лечения.
Для большинства ингибиторов протеазы NS3 частота естественного возникновения единичных RAS среди пациентов инфицированных 1 генотипом составляет от 0,1% до 3,1%, в тоже время пациенты, которые не продемонстрировали ответ на лечение Симепревиром имели мутации NS3 в положениях 80, 122, 155 и/или 168. Встречающаяся в естественных условиях резистентность отмечалась у 4,1–18,9% инфицированных пациентов с исходными мутациями NS3. Обнаружение резистентных вариантов 1 генотипа на начальном этапе, может представлять важную информацию для более специфического и эффективного клинического ведения данной группы.
Врачи подчеркивают важность оценки замещений, связанных с резистентностью к NS3, в контексте лечения вирусных инфекций, таких как гепатит C. Они отмечают, что наличие RAS может существенно влиять на эффективность терапии, особенно при использовании прямых противовирусных средств. Специалисты рекомендуют проводить генетическое тестирование для выявления этих замещений, так как это позволяет адаптировать лечение и повысить его результативность. Врачи также акцентируют внимание на необходимости мониторинга динамики RAS в процессе терапии, что может помочь в своевременной коррекции схемы лечения. Таким образом, понимание и оценка RAS становятся ключевыми факторами для достижения устойчивой вирусологической реакции у пациентов.

Методы
В общей сложности были получены 73 образца сыворотки крови у 15 пациентов, принимавших Боцепревир / Телапревир, и у 58 пациентов ранее не получавших ПППД, до начала терапии Симепревиром, Даклатасвиром и/или Софосбувиром. Присутствие базовых резистентных замен (RAS) в сериновом протеазном домене NS3 анализировали секвенированием нуклеотидов с последующим аминокислотным удержанием.
Результаты
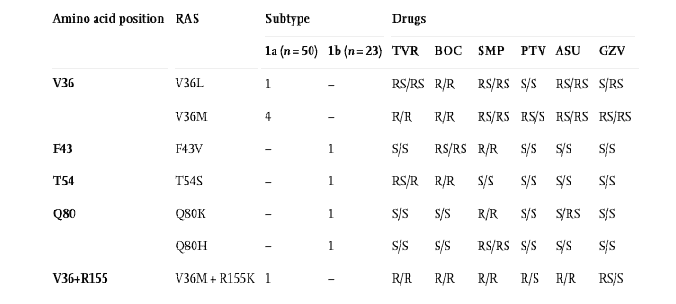
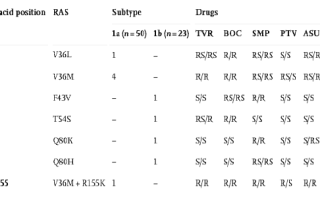
Общая распространенность RAS
в этом исследовании составила 13,7% (10/73). Распространенность RAS для подтипа
1b ВГС составляла 17,4% (4/23), в то время как для подтипа 1a ВГС составляла
12% (6/50). Первичные мутации V36M/L и R155K наблюдались только у подтипа 1a,
тогда как T54S и Q80K были обнаружены только у подтипа 1b. RAS V36M, который
связан со снижением восприимчивости к ИП второго поколения, был наиболее частым
в исследовании (6,9%; 5/73).
Оценка замещений, связанных с резистентностью к NS3 (RAS), вызывает активные обсуждения среди специалистов в области вирусологии и инфекционных заболеваний. Многие исследователи подчеркивают важность понимания механизмов, лежащих в основе резистентности вируса, поскольку это может существенно повлиять на выбор терапии для пациентов с хроническими инфекциями. Некоторые эксперты отмечают, что наличие определенных RAS может предсказывать не только эффективность лечения, но и вероятность рецидива заболевания.
С другой стороны, существуют мнения, что не все RAS имеют одинаковое значение, и их интерпретация требует тщательного анализа в контексте клинической практики. Важно учитывать, что генетическая изменчивость вируса может варьироваться в зависимости от популяции и региона, что делает универсальные рекомендации сложными. В целом, обсуждение RAS подчеркивает необходимость индивидуализированного подхода к лечению, основанного на генетическом профиле вируса и состоянии пациента.

Обсуждение
В этом исследовании был произведен анализ 73 пациентов инфицированных 1a и 1b подтипом ВГС для выявления и оценки распространенности ранее сообщавшихся в литературе вариантов RAS. До конца 2015 года Телапревир и Боцепревир были единственными ИП доступными для лечения гепатита С в Бразилии. Однако лицензирование трех препаратов в 2015 году (Симепревир, Даклатасвир и Софосбувир) позволило использовать новые комбинированные варианты лечения. Симепревир, ИП второй волны, был рекомендован для пациентов без опыта предыдущего лечения заболеваний печени, в то время как комбинация Даклатасвира и Софосбувира была основной терапией для широкой группы пациентов независимо от анамнеза, включая пациентов с декомпенсированным циррозом печени. Совсем недавно, в клинические протоколы для терапии 1 генотипа были включены другие ИП, такие как Паритапревир в сочетании с Дасабувиром/Омбитасвиром и Гразопревиром с Эльбасвиром.
Как и ожидалось, распространенность RAS среди пациентов прошедших лечение препаратами первого поколения без достижения УВО (Телапревир/Боцепревир) была существенно выше по сравнению с пациентами без опыта предыдущего лечения. Данные резистентные замены представляют собой отрицательный фактор прогноза при использовании новых ПППД. Записи в медицинской документации не описывают, какой период времени прошел до момента отбора образцов сыворотки у пациентов после неуспешного лечения препаратами первой волны. Тем не менее, ранее отсутствие ответа на ПППД также может быть связано и с другими факторами: наличие цирроза печени и высокая вирусная нагрузка на момент начала терапии.
Распространенность NS3 RAS
во 2-й группе была ниже для 1a подтипа (5,6%) по сравнению с 1b подтипом
(18,1%). Наличие резистентности у пациентов 1b подтипа, без опыта предыдущего
лечения, свидетельствует инфецировании штаммами с первичной RAS. Учитывая обе
группы, это исследование выявило более высокое распространение RAS в
последовательностях 1b подтипа по сравнению с подтипом 1a (17,4% против 12%),
что имеет явное отличие от наблюдений в предыдущем бразильском исследовании с
участием доноров крови, где присутствие RAS в 1a подтипе был значительно выше,
чем в 1b подтипе (20% против 8%). Это может быть связано с популяционными
различиями (более 20% наших образцов были взяты у пациентов имевших опыт
неудачного лечения ПППД).
Согласно обзору современной литературы, первичными мутациями устойчивости к различным ИП считаются V36M, T54S, Q80K и R155K. При этом, V36M и R155K могут снизить восприимчивость к недавно одобренным ИП Симепревиру, Паритапревиру и Гразопревиру. T54S связан с устойчивостью к препаратам первой волны — Телапревиру. В свою очередь, Q80K вызывает устойчивость к Симепревиру.
Присутствие RAS V36M у четырех пациентов может быть связано с предыдущим опытом неудачного лечения Телапревиром. Выявление этой замены у одного пациента из 2 группы предположило первичную инфекцию с лекарственно-устойчивым вариантом. Для всех пяти пациентов с RAS V36M не должна рассматриваться комбинированная терапия с ИП нового поколения, поскольку V36M связан с устойчивостью к большинству одобренных ингибиторов NS3. Для данной группы пациентов был выбран вариант лечения Софосбувиром в сочетании с Даклатасвиром, и у всех пяти пациентов наблюдалось достижение УВО спустя 12 недель после окончания лечения. В рамках данного исследовании мы провели ретроспективный анализ для определения распространенности мутаций резистентности среди пациентов получавших Телапревир, и мутация V36M была выявлена у 28/232 (12%) пациентов, которые не смогли успешно пройти терапию данным препаратом. Барнард определил варианты мутаций устойчивости среди пациентов с 1а подтипом, не отвечающих на тройную терапию с Боцепревиром/пег-ИФН/РБВ, и пришел к выводу, что V36M может быть основной причиной неудачи при с использованием ИП первой волны. Результаты данного исследования продемонстрировали, что мутации V36M были обнаружены у всех групп пациентов включенных в исследование независимо от предыдущего опыта лечения, это обуславливает важность постепенного прекращения использования ИП первого поколения с целью минимизации риска возникновения резистентности и улучшения достижения УВО для пациентов.
Среди RAS, наблюдаемых у пациентов из 2 группы, RAS T54S была идентифицирована только у одного пациента, инфицированного 1b подтипом. Ранее было показано, что эта мутация вызывает устойчивость к Боцепревиру и Телапревиру, но не к Симепревиру. Эта информация была подтверждены, так как данный пациент достиг УВО после 12 недель лечения Симепревиром. Кроме того, как ранее также сообщалась в предыдущих исследованиях, наблюдается низкая распространенность RAS T54S (4,6%) среди пациентов Бразилии, ранее не получавших лечение ПППД.
В настоящем исследовании RAS Q80K не наблюдался в изолятах 1a подтипа и был обнаружен только в одном образце 1b подтипа у пациента 2 группы с компенсированным циррозом печени, сахарным диабетом 2 типа и системной артериальной гипертензией. В 2016 году этот пациент не имел явных клинических симптомов и принял решение не использовать для лечения доступные на тот момент варианты ПППД. Q80K чаще всего наблюдается у изолятов 1a подтипа и редко выявляется у 1b подтипа. Исследования показали высокую распространенность мутации Q80K в США (37–47%). Сарразин оценивал исходную RAS3 NS3 среди группы 467 пациентов, а результаты по полиморфизму Q80 продемонстрировали высокую распространенность как среди пациентов с опытном лечения ИП (110/265; 41,5%), так и пациентов, не получавших ИП (93/202; 46%). В отличие от информации из других стран, распространенность Q80K в Бразилии низкая.
RAS R155K связан с устойчивостью к ИП первой и второй волны. Наше исследование демонстрирует более высокую частоту неуспешного лечения для пациентов с 1a подтипом по сравнению с 1b подтипом. Сарразин описал, что комбинация замен V36M+R155K обуславливает высокую устойчивость к Телапревиру. В данном исследовании комбинация мутаций в локусах 36 (V36M) и 155 (R155K) была выявлена у одного пациента с опытом лечения Телапревиром и 1а подтипом ВГС. После 12 недель терапии Телапревиром вирусная нагрузка составила 4,74 log10 МЕ/мл, после чего было принято решение приостановить лечение. RAS R155K придает устойчивость ко всем доступным ИП для штаммов 1а подтипа, что обуславливает необходимость использовать новые препараты ПППД нацелены на другие неструктурные белки ВГС. Для вышеупомянутого пациента, была выбрана «спасательная терапия» с использованием ингибиторов NS5B и NS5A, а РНК ВГС была необнаружима спустя 4 недели.
В настоящем исследовании были идентифицированы замены V36L, F43V и Q80H. RAS V36L связан с устойчивостью к Боцепревиру. Кроме того, в 2015 году произошли изменения в Бразильском национальном руководстве по клинической практике лечения гепатита С где более не учитывались комбинированные методы лечения с применением Боцепревира или Телапревира в качестве основного варианта лечения ВГС. После идентификации RAS V36L у пациента с 1а подтипом ВГС из 2 группы была начата 12-недельная терапия Симепревиром. Поскольку V36L не оказывает влияние на восприимчивость к этому препарату, УВО был достигнут без осложнений.
Анализ мутаций, связанных с вариантами резистентности, среди пациентов, инфицированных 1b подтипом ВГС, показал наличие RAS F43V у пациента ранее не проходившего лечения ПППД. Насколько нам известно, это первое сообщение об обнаружении данной мутации в естественных условиях. Профиль резистентности к ИП был описан in vitro и указывает на то, что локус F43 связан с устойчивостью к Симепревиру. RAS Q80H, который может существенно снизить восприимчивость к Симепревиру, был выявлен у одного из пациентов 2 группы инфицированного 1b подтипом. Для данного пациента была выбрана схема терапии с использованием Боцепревира, на который Q80H не оказывает влияние и после лечения был достигнут УВО.
Источник:
«Prevalence of baseline NS3 resistance-associated substitutions (RASs) on treatment with protease inhibitors in patients infected with HCV genotype 1»
Clinics and Research in Hepatology and Gastroenterology
15 March 2019
Коллектив авторов:
- Vanessa Duarte Costa, Nathália Delvaux, Carlos Eduardo Brandão-Mello и другие
- Laboratório de Hepatites Virais, Instituto Oswaldo Cruz, FIOCRUZ, avenida Brasil, 4365 – Manguinhos, 21040-900, Rio de Janeiro, RJ, Brazil
- Hospital Universitário Gaffrée & Guinle, UNIRIO, R. Mariz e Barros, 775 – Maracanã, 20270-001, Rio de Janeiro, RJ, Brazil
- Instituto Nacional de Infectologia Evandro Chagas, INI/FIOCRUZ, avenida Brasil, 4365 – Manguinhos, 21040-360, Rio de Janeiro, RJ, Brazil

Вопрос-ответ
Что такое NS3, NS4, NS5?
Спектр anti-НСV (core, NS3, NS4, NS5) — это специфические антитела к отдельным структурным и неструктурным белкам вируса гепатита С.
Что такое РАУ при ВГС?
Наиболее клинически значимым рецептором NS5A при вирусном гепатите C генотипа 3 является Y93H, который обусловливает высокий уровень резистентности к даклатасвиру и велпатасвиру. Распространенность рецептора Y93H составляет от 5% до 10% у лиц с вирусным гепатитом C генотипа 3, ранее не подвергавшихся воздействию ингибиторов NS5A.
Ингибитором протеазы NS3 4A вируса гепатита С является?
Нарлапреви́р (SCH 900518) — ингибитор NS3/4A сериновой протеазы вируса гепатита C, предназначенный для лечения хронического гепатита С (генотип 1) в комбинации с другими противовирусными препаратами.
Какие препараты убивают вирус гепатита С?
В клиническую практику входят такие ингибиторы протеазы NS3/4A, как телапревир, боцепревир и препараты последнего поколения симепревир и софосбувир. Эти аналоги нуклеозидов применяются в комбинации со стандартной терапией препаратами пегилированного интерферона и рибавирина (тройная терапия).
Советы
СОВЕТ №1
Изучите основные механизмы резистентности к NS3, чтобы лучше понять, как различные замещения могут влиять на эффективность лечения. Это поможет вам более осознанно подходить к выбору терапии.
СОВЕТ №2
Регулярно проводите генетическое тестирование вируса, чтобы выявить наличие RAS. Это позволит своевременно корректировать лечение и повысить шансы на успешное выздоровление.
СОВЕТ №3
Обсуждайте результаты тестирования с вашим лечащим врачом. Совместный анализ данных поможет выбрать наиболее подходящую стратегию лечения и минимизировать риск неэффективности терапии.
СОВЕТ №4
Следите за новыми исследованиями и рекомендациями в области лечения инфекций, связанных с NS3. Научные данные постоянно обновляются, и это может повлиять на ваш план лечения.